
L’insuline, cette inconnue
L’insuline est, avec le glucagon, une hormone clé pour régulariser la glycémie. Mais saviez-vous que son action ne se limite pas à cela ? Saviez-vous que, grâce au mode alimentaire pauvre en glucides, vous pouvez diminuer votre sécrétion d’insuline et perdre du poids tout en équilibrant mieux votre diabète… En voici le mécanisme…
Avis au lecteur: Vous pouvez également lire cet article dans son intégralité dans sa version Word originale, en cliquant sur "N°14 L'insuline, cette inconnue.pdf" tout en bas de la page.
L’insuline, c’est quoi ?
L'insuline (du latin : insula « île ») est une hormone peptidique (une protéine donc) sécrétée par les cellules β des îlots de Langerhans du pancréas. Elle joue un rôle majeur dans la régulation de certains substrats énergétiques, dont le principal est le glucose. Sans insuline, les taux normaux de glucose sanguin (glycémies) ne sont pas maintenus.
Chez les êtres humains, l’absence totale d’insuline est fatale dans un délai de quelques mois[1]. C’est le cas dans le diabète insulinodépendant (ou diabète de type 1), où le pancréas n’en sécrète plus parce que les cellules β sont détruites (très probablement par un processus auto-immunitaire).
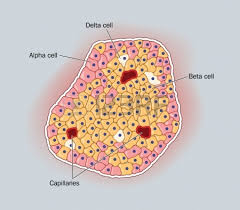
Schéma microscopique d’un îlot de Langerhans[2] : les cellules β (Beta cell) sécrètent l’insuline, les cellules α (Alpha cell) sécrètent le glucagon.
Heureusement, on ne meurt plus du diabète de type 1
Cependant, depuis 1922, on ne meurt plus de ce type de diabète. Banting et Best[3] furent en effet les premiers à utiliser des extraits pancréatiques en injection chez un jeune garçon de 14 ans souffrant de diabète de type 1 (appelé «diabète juvénile» à l’époque[4]) et le sauvèrent de la mort grâce à l’insuline contenue dans les extraits pancréatiques[5]. Depuis, l’insuline en a été extraite, purifiée, et même synthétisée. Aujourd’hui, la médecine dispose de plusieurs types d’insulines injectables très performantes: des formes rapides, ultra-rapides, semi-rapides, lentes, et les « mix » de rapides et semi-lentes[6]. Grâce à plusieurs  injections par jour, les diabétiques de type 1 arrivent à éviter les complications du diabète et à survivre ainsi pendant de nombreuses années.
injections par jour, les diabétiques de type 1 arrivent à éviter les complications du diabète et à survivre ainsi pendant de nombreuses années.
Figure : Frederick G. Banting (à droite) et Charles Best (à gauche sur la photo) découvrirent et commercialisèrent l’insuline en 1922.
Et le diabète de type 2 ?
En ce qui concerne le diabète de type 2 non insulinodépendant (qui constituent les 85 à 90% des cas de diabète), le dérèglement de l’insuline en est également la grande cause, mais d’une manière toute différente: ici, pas d’absence de production d’insuline, du moins au début.
Par contre, la maladie commence généralement par une résistance à l’insuline, en ce sens que l’organisme y devient de moins en moins sensible. Ceci a pour effet que le pancréas est contraint d’en produire de plus en plus afin de maintenir les glycémies (taux de glucose dans le sang) à des niveaux acceptables. Si aucun traitement (adaptation du mode alimentaire, accroissement de l’activité physique, médications, etc…) n’est instauré, l’insulinorésistance s’aggrave inéluctablement, de sorte que l’insuline n’arrive plus à maintenir des glycémies normales. Le diabète s’installe avec ses hyperglycémies incontrôlables et, bien plus tard, la survenue possible d’une série de complications. Finalement, dans le diabète de type 2 également, le pancréas en s’épuisant finit par ne plus pouvoir produire assez d’insuline, qu’il faudra alors injecter comme dans le type 1 pour éviter les complications et obtenir la survie du patient.
Qu’est-ce qui déclenche la production de l’insuline ?
Physiologiquement, l'insuline est sécrétée en fonction de l'état nutritionnel. Par contre, sa production est ralentie lors de l'activité physique, d’un état de jeûne, d’une situation de stress, et d’un traumatisme.
Lors d’un apport alimentaire, la sécrétion d’insuline sera augmentée par la nécessité de mettre les nutriments en réserve[8] :
D’abord, dès avant le début du repas, les stimulations visuelles, olfactives, gustatives que provoque la nourriture par l’intermédiaire du système nerveux central, activent la production d’insuline par les cellules β du pancréas[9].
Ensuite, pendant le repas, sous l'influence directe de la présence des aliments dans le tube digestif, la sécrétion d'insuline est stimulée par le système des incrétines (les hormones gastro-intestinales).
Dès que les glucides sont dégradés dans l’intestin et passent dans le sang sous forme de glucose, l'élévation de la glycémie provoque une forte sécrétion d’insuline.
Par contre, cette sécrétion d’insuline diminue celle du glucagon, sécrété par les cellules α [11]. Le glucagon a l’effet inverse à celui de l’insuline, c.-à-d. qu’il a un effet hyperglycémiant. La régulation de la glycémie résulte d’un équilibre entre les effets opposés de ces deux hormones. En cas d’hypoglycémie réactionnelle, le glucagon permet le retour de la glycémie à la normale.
Plus forte est l’élévation de la glycémie, plus importante sera la quantité d’insuline libérée[12]. Le glucose est donc le stimulus le plus important pour la production de l’insuline et c’est celui auquel les cellules β sont les plus sensibles chez l’homme et les animaux.
En cas de jeûne, l’organisme, manquant d’apport énergétique, doit mobiliser ses réserves par déstockage du glucose, des acides gras, des acides aminés. La production d’insuline sera inhibée, ce qui est logique puisqu’il celle-ci possède une action anabolisante.
En cas d’exercice musculaire, les réserves doivent également être mobilisées et le pancréas produira par conséquent moins d’insuline. C’est le cas également lors d’un stress et/ou d’un traumatisme. Mais alors, en réponse à ce stress ou ce traumatisme, le contrôle du métabolisme énergétique est récupéré par l’adrénaline et le cortisol sécrétés par la surrénale, qui sont, tout comme le glucagon, des hormones antagonistes à l’insuline[13]. Selon qu'elles soient hyperglycémiantes ou hypoglycémiantes, les hormones mises en jeu n'agissent pas de la même manière, ni au même moment.
A quoi sert l’insuline ? Quel est son mode d’action ?
Globalement, lorsqu’elle est produite pendant et après un repas, l'action de l'insuline est souvent résumée par son effet hypoglycémiant (baisse du taux de glucose dans le sang). Mais saviez-vous que son action influence aussi les graisses et même les protéines ? En réalité, l’insuline est l’hormone majeure du contrôle du métabolisme énergétique. Elle coordonne l’utilisation des substrats énergétiques. Ses effets sont anaboliques, puisqu’ils favorisent les synthèses, à savoir le stockage du glycogène dans le foie et les muscles (glycogénogenèse), elle stimule aussi la conversion de l’excès du glucose en acides gras (lipogenèse), et elle favorise l’entrée des acides aminés en vue de la synthèse protéique dans la majorité des tissus (protéogenèse) [14]. L’insuline a donc de multiples fonctions.
Résumé des différentes actions de l’insuline [15], [16] :
1) Sur le métabolisme des glucides :
Les lieux de stockage du glucose sont les muscles, le tissu adipeux et le foie.
- Au niveau des muscles et du foie : l’insuline active la synthèse du glycogène. Elle permet la reconstitution des réserves du glycogène dans ces tissus (glycogénogenèse).
- Au niveau des muscles et du tissu adipeux : l’insuline stimule l’entrée du glucose dans les cellules de ces tissus. Le prélèvement accéléré du glucose dans le sang diminue la glycémie et entraîne par voie de conséquence la baisse de la sécrétion de l’insuline.
- Au niveau du foie : l’insuline inhibe la néoglucogenèse (voir ci-dessous) et la mobilisation du glycogène (par l’inactivation d’une enzyme, la glycogène phosphorylase). Donc, en cas d’abondance de glucides, comme c’est le cas après un repas, l'insuline bloque la production de glucose par le foie, ce qui fait davantage baisser la glycémie.
Cette production de novo de glucose par le foie ne peut se prolonger car elle utilise directement les muscles (avec pour conséquence une fonte musculaire), plutôt que les réserves énergétiques quantitativement bien plus importantes du tissu adipeux.
Lors du jeûne prolongé (au-delà de quelques jours chez l'adulte, mais seulement quelques heures chez le nouveau-né et le nourrisson), la poursuite de la baisse de l'insuline permet la production des corps cétoniques[22], ce qui permet l'épargne musculaire, car les corps cétoniques sont dérivés des acides gras du tissu adipeux.
Remarque :
- Les corps cétoniques sont trois métabolites — l'acétylacétate, le β-D-hydroxybutyrate et l'acétone — produits par le processus de cétogenèse[23] dans le foie à partir de la dégradation des lipides — et plus particulièrement des acides gras — lorsque l'organisme ne dispose plus de réserves suffisantes en glucides, et notamment en glucose.
Au-delà de son effet immédiat sur la régulation des flux de substrats, l'insuline a des effets à plus long terme sur la croissance ; c'est une hormone anabolisante. Il est ici intéressant de souligner la forte homologie entre l'insuline et le principal facteur de la croissance, l’insulin-like growth factor (IGF-1)[24], ou « facteur de croissance apparenté à l'insuline ». L'insuline en tant que molécule de signalisation de la présence d'aliments dans le tube digestif peut être assimilée à une hormone de l'abondance, signalant le surplus énergétique permettant la croissance. L'insuline a des effets anabolisants directs, par son action sur les métabolismes des glucides, protéines et lipides, mais aussi indirects, par la régulation des protéines porteuses de l'IGF-1.
Et chez les diabétiques ?
De tout ceci découle que les diabétiques qui suivent un mode alimentaire hypoglucidique (pauvre en sucres), économiseront ainsi avantageusement leur insuline, soit celle, totalement absente, qu’ils sont obligés de s’injecter, dans le type 1 ; soit celle qui ne remplit plus parfaitement son rôle dans le type 2. Ceci leur permettra de maintenir plus facilement leurs glycémies dans les normes admises au cours de leur traitement. Mais ce n’est pas tout…
En effet, plus il est possible de maintenir une insulinémie basse, moins les glycémies fluctueront (avec d'autant moins de risques d’hypo- que d’hyperglycémies), et moindre sera aussi l’accumulation de graisses dans les cellules graisseuses — donc moins de prise de poids — ce qui est évidemment bénéfique, surtout en cas de diabète T2, où la surcharge pondérale est un élément très négatif qui contribue à l’insulinorésistance.
Mais attention au régime à outrance trop pauvre en glucides !
Il est important d’expliquer clairement à tout diabétique qu’un régime hypoglycémique ne peut être tel, qu’il devienne trop ou trop longtemps cétogène. Dans ce cas, l’organisme ne brûle plus que des graisses, et le glucose, obligatoirement nécessaire au cerveau, aux reins, et aux érythrocytes (globules rouges), n’est alors plus disponible que par la néoglucogenèse. Ce sera au détriment de la masse graisseuse bien-sûr, mais aussi de la masse maigre, c’est-à-dire des muscles notamment ! Une telle situation n’est médicalement pas tenable ou peut en tout cas provoquer à terme des effets indésirables graves, s'il n'y a pas de suivi médical strict.
Donc, mode alimentaire hypoglucidique comprenant suffisamment de bons glucides à bas indices et charges glycémiques : OUI ! Mais régime hypoglycémique à outrance sur de longues périodes : NON ! Ce serait comme suivre un jeûne prolongé et incontrôlé à l’infini… Si un jeûne médicalement bien contrôlé peut être avantageux dans le traitement de certaines maladies, dont le cancer et le diabète de type 2, il est par contre formellement contre-indiqué de se lancer dans une telle aventure sans les conseils et le suivi de personnes qualifiées. Nous aurons l’occasion de revenir sur ce problème plus tard.
Et quand la néoglucogenèse nous joue des tours !
Je vous livre mon expérience personnelle, anecdotique donc, d’un diabète de type 2 bien équilibré depuis 20 ans (hémoglobine glyquée maintenue à 4,7% depuis un an, ce qui correspond à 28 mmol/mol) grâce surtout au mode alimentaire hypoglucidique mais suffisamment riche en bons glucides, en bonnes graisses et en protéines, une activité physique régulière, et la prise de seulement deux médicaments antidiabétiques oraux. Je pèse actuellement 58 kg pour 1,65 m de taille (IMC, indice de la masse corporelle : 21,3). Le mode alimentaire que je me suis imposé m’a en effet permis de maigrir progressivement de 25% de mon poids originel lors du diagnostic (qui était de 77 kg).
Un jour, sans doute dans le but de parfaire encore mon alimentation, je dîne en mangeant un minimum de glucides provenant de légumes crus et cuits non féculents. Quantité normale de protéines et de lipides. Surprise le lendemain matin ! Une glycémie à jeun largement au-dessus de 100 mg/dL (5,5 mmol/L) ! Comment était-ce possible ? Alors que je n’avais absorbé aucun méchant sucre la veille au soir, et que mes glycémies à jeun se situaient généralement entre 70 et 100 mg/dL (ou de 3,9 à 5,5 mmol/L)… Une explication pourrait être : la néoglucogenèse, mais il peut également s'agir du phénomène de l'aube, ou même d'une gastroparèse diabétique ou estomac paresseux (nous y reviendrons ultérieurement).
Où se trouve la cause?
On passe la nuit à jeun, donc sans stimulation insulinique. Physiologiquement, l’insulinémie baisse aussi la nuit. C’est normal, puisqu’on en a moins besoin. La sécrétion de base d'insuline persiste néanmoins la nuit et est normalement suffisante pour couvrir la production de glucose par le foie (néoglucogenèse), en tout cas chez un non-diabétique. Mais un diabétique T2 qui suit une diète pauvre en glucides réagit différemment, surtout s'il ne produit plus beaucoup d'insuline : même la nuit, il a besoin d’un minimum de glucides : la néoglucogenèse les lui fournit. Moins il a accumulé de glucides alimentaires la veille, plus la néoglucogenèse sera active la nuit. Mieux, elle dépassera son but ! Car l’insuline qu’il produit moins est en plus d’une qualité médiocre à cause de l’insulinorésistance. Or, l’insuline est requise pour freiner la néoglucogenèse. De là : danger d’une hyperglycémie à jeun par production accrue de glucose par le foie durant la nuit (vers 3 h du matin), alors qu’on croit n’avoir commis aucune erreur alimentaire au cours des heures précédentes…
Autre précision : la néoglucogenèse nocturne, correspondant à une activité métabolique du foie augmentée, provoque un réveil très désagréable en pleine nuit, qui souvent, empêche de se rendormir avant quelques heures.
Le remède?
Si l'on produit encore assez d'insuline, on peut stimuler le pancréas par un insulinosécréteur, ce que j'ai fait pendant des années. J'ai pris un ½ comprimé de glibenclamide (un antidiabétique oral stimulateur de la sécrétion d’insuline) vers 23 h avant d’aller dormir, ce qui m'a fait produire assez d'insuline endogène pour maintenir des glycémies à jeun parfaites, ainsi qu’un sommeil continu. Peut-être y a-t-il d'autres solutions qui pourraient être meilleures... Mais ça, c’est une autre histoire, dont je parlerai volontiers lorsqu’il s'agira du traitement du diabète par des médicaments, dont évidemment l'insuline.
Ce qu’il faut retenir :
-
Le pancréas sécrète de l’insuline surtout en réponse à une augmentation de la glycémie.
-
L’insuline rétablit une glycémie normale en augmentant le transport du glucose sanguin vers les cellules, principalement vers les cellules musculaires et adipeuses.
-
L’insuline a plusieurs autres effets :
-
« stockage » de glucides, mais aussi de protéines et de lipides dans les tissus.
-
Parallèlement, « blocage » de la dégradation des protéines, des matières grasses et des glucides dans l’organisme.
-
Une insulinémie élevée (par trop de glucose dans le sang) :
-
Freine le brûlage des graisses (pour la production d’énergie) ;
-
Favorise le stockage des nutriments ingérés, surtout sous forme de graisses (prise de poids).
-
Les modes alimentaires pauvres en mauvais glucides (ceux dont l’indice et la charge glycémique sont hauts), et riches en bons lipides et en protéines:
-
Font baisser la glycémie de manière significative[25] chez les personnes diabétiques ou non ;
-
Font parallèlement baisser leurs taux d’insuline[26], tout au long d’une journée, y compris après les repas ; une légère baisse de l’insulinémie peut entraîner presque immédiatement un accroissement du brûlage des graisses[27].
-
Forment une condition essentielle favorisant le brûlage des graisses et limitant leur synthèse, ce qui a une répercussion sur le poids (qui diminue), mais aussi sur les taux sanguins de lipides et de cholestérol (qui s’améliorent).
(A suivre).
Luc Vangermeersch, 18 avril 2014
Bibliographie :
[1] http://fr.wikipedia.org/wiki/Insuline
[2] http://www.google.fr/imgres?imgurl=http%3A%2F%2Fus.123rf.com%2F450wm%2Fhfsimaging%2Fhfsimaging1206%2Fhfsimaging120600040%2F14192066-drawing-of-a-pancreatic-islet-of-langerhans-showing-the-alpha-beta-and-delta-hormone-producing-cells.jpg&imgrefurl=http%3A%2F%2Ffr.123rf.com%2Fprofile_hfsimaging&h=394&w=450&tbnid=z_Wl3t5cqY0c-M%3A&zoom=1&docid=uAQ9tvYfs-TBSM&ei=LAAzU4OGK4nX0QXTs4GIBQ&tbm=isch&iact=rc&dur=5827&page=4&start=59&ndsp=21&ved=0CLMCEK0DMEc
[3] http://bantingandbest.utoronto.ca/history/
[4] http://nl.wikipedia.org/wiki/Diabetes_mellitus#Juveniele_versus_ouderdomsdiabetes
[5] http://www.google.fr/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&ved=0CDUQFjAB&url=http%3A%2F%2Fwww.integrascol.fr%2Fdocuments%2FHistoire%2520Insuline.doc&ei=66EkU_32Ear20gWsloHoAQ&usg=AFQjCNEcZDr_7Kz-ZMcnrYSClXBpZIqF1w&bvm=bv.62922401,d.bGE
[6] http://www.diabetesfonds.nl/artikel/soorten-insuline
[7] http://www.google.fr/imgres?imgurl=http%3A%2F%2Fobnet.chez-alice.fr%2Fimages%2FHND2.gif&imgrefurl=http%3A%2F%2Fobnet.chez-alice.fr%2Fp0461.htm&h=284&w=430&tbnid=P0wfw9bBZ_uQtM%3A&zoom=1&docid=NxYpaoZij0UWWM&ei=PK01U7OyL-en0AXchoGgDQ&tbm=isch&iact=rc&dur=353&page=2&start=15&ndsp=21&ved=0CI4BEK0DMBI
[8] http://lyon-sud.univ-lyon1.fr/servlet/com.univ.collaboratif.utils.LectureFichiergw?ID_FICHIER=1320397715984
[9] http://lyon-sud.univ-lyon1.fr/servlet/com.univ.collaboratif.utils.LectureFichiergw?ID_FICHIER=1320397715984
[10] http://www.google.fr/imgres?imgurl=http%3A%2F%2Fsokanaa.com%2Fwp-content%2Fuploads%2F2013%2F05%2Fglycemie.png&imgrefurl=http%3A%2F%2Fsokanaa.com%2Fnous%2Fglycemie%2F&h=293&w=510&tbnid=0Ov7pYEpziZlQM%3A&zoom=1&docid=Oacnmcc6CrjSvM&ei=V7Q1U8KIB6i70QWt-4DADA&tbm=isch&iact=rc&dur=927&page=1&start=0&ndsp=13&ved=0CGcQrQMwBQ
[11] http://cbzinsou.pagesperso-orange.fr/CH-18.htm
[12] Médart J, Houlbert A, « Le nouveau régime IG diabète », Thierry Souccar Éditions, 2012, p 70
[13] http://fr.wikipedia.org/wiki/R%C3%A9gulation_de_la_glyc%C3%A9mie
[14] http://cbzinsou.pagesperso-orange.fr/CH-18.htm
[15] http://fr.wikipedia.org/wiki/Insuline#Mode_d.27action
[16] http://cbzinsou.pagesperso-orange.fr/CH-18.htm#_Toc143947291
[17] http://www.google.fr/imgres?imgurl=http%3A%2F%2Fwww.svt-biologie-premiere.bacdefrancais.net%2Fglycogenese.jpg&imgrefurl=http%3A%2F%2Fwww.svt-biologie-premiere.bacdefrancais.net%2Fregulation-glycemie.php&h=466&w=754&tbnid=wks_XLHvUV4cpM%3A&zoom=1&docid=23fcVwfQt022vM&ei=z7M2U_eeLIGX1AXX7IDIAg&tbm=isch&iact=rc&dur=2607&page=3&start=37&ndsp=21&ved=0COIBEK0DMCw
[18] Deshusses E F, Thèse, Université de Genève, 2000.
[19] http://fr.wikipedia.org/wiki/N%C3%A9oglucogen%C3%A8se
[20] http://fr.wikipedia.org/wiki/Acide_lactique
[21] http://monde.ccdmd.qc.ca/ressource/?demande=desc&id=54279
[22] http://fr.wikipedia.org/wiki/Corps_c%C3%A9toniques
[23] http://fr.wikipedia.org/wiki/C%C3%A9togen%C3%A8se
[24] http://fr.wikipedia.org/wiki/IGF-1
[25] Boden G, Sargrad K, Homko C, Mozzoli M, Stein T P: “Effect of Low-Carbohydrate Diet on Appetite, Blood Glucose Levels, and Insulin Resistance in Obese Patients with type 2 Diabetes”. Annals of Internal Medecine 142 (2005), 403-411.
[26] Volek JS, Sharman MJ, Love DM, Avery N G, Gomez A L, Scheet T P, et al.: “Body Composition and Hormonal Responses to a Carbohydrate-Restricted Diet”. Metabolism 51 (2002), 864-870.
[27] Jensen M D, Caruso M, Heiling V, Miles J M: “Insulin Regulation of Lipolysis in Nondiabetic and IDDM Subjects”. Diabetes 38 (1989), 1595-1601.








![Het diagram [7] toont over de loop van jaren de evolutie van insulineresistentie en de afscheidingscapaciteit van insuline bij type 2 diabetes. Het gaat om een fictief voorbeeld. In feite, als de diabetes goed geregeld is, kan insulinetherapie pas veel later nodig zijn (heel wat meer dan 10 jaar), of zelfs helemaal niet.](http://img.over-blog-kiwi.com/0/67/32/95/20140424/ob_72444d_dsc02968.JPG)
![Evolutie van de glycemie na de inname van koolhydraten[10].](http://img.over-blog-kiwi.com/0/67/32/95/20140424/ob_d2b597_dsc02957.JPG)
![Synthese en afbraak van glycogeen in de levercellen[17].](http://img.over-blog-kiwi.com/0/67/32/95/20140424/ob_9fd535_dsc02943-copie.JPG)


![Schéma[7] montrant l’évolution au cours des années de l’insulinorésistance et de la capacité de sécrétion d’insuline dans le diabète de type 2. Il ne s’agit que d’un exemple fictif. En réalité, lorsque le diabète est bien équilibré, la nécessité d’une insulinothérapie peut ne s’avérer que bien plus tard (bien plus que 10 années), et parfois même pas du tout.](http://img.over-blog-kiwi.com/0/67/32/95/20140423/ob_c16726_dsc02967.JPG)
![Évolution de la glycémie après ingestion de glucides[10]](http://img.over-blog-kiwi.com/0/67/32/95/20140423/ob_b9621a_dsc02956.JPG)
![Synthèse et dégradation du glycogène dans les cellules hépatiques[17]](http://img.over-blog-kiwi.com/0/67/32/95/20140423/ob_d62ada_dsc02958.JPG)



/image%2F0673295%2F201307%2Fob_46ba1e_bdbcff82fa665af64995d563d19afded-normal.jpeg)